등록 : 2006.12.29 01:50
수정 : 2006.12.29 01:50
 |
|
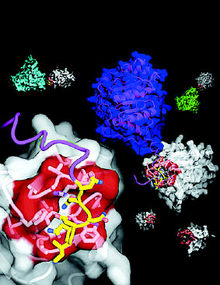
오병하 포스텍 교수 연구팀이 규명해 <몰레큘러 셀> 표지에 실린 단백질의 특정영역(B30.2/SPRY) 3차원 구조. 왼쪽 붉은색 부분이, 다른 단백질에 존재하는 6개 아미노산의 짧은 서열(노란색)을 인식해 서로 결합한다.
|
바이러스 차단 단백질 핵심구조 규명
권위지 ‘몰레큘러 셀’ 표지에
국내 연구진이 에이즈 바이러스를 차단하는 단백질 등 질환 관련 단백질들의 핵심 구조와 기능을 밝혀 신약 개발에 한걸음 더 다가갔다.
오병하(45) 포스텍(포항공대) 생명과학과 교수 연구팀은 28일 “에이즈 바이러스의 증폭을 차단하는 ‘TRIM5’ 단백질 등 의학적으로 중요한 기능을 하는 단백질에서 공통으로 발견되는 특정 영역(B30.2/SPRY)의 3차원 구조를 밝히고, 이 영역이 다른 단백질들과 결합하는 방식을 규명했다”고 밝혔다. 연구팀의 연구성과는 분자생물학분야 권위지인 <몰레큘러 셀>(셀 자매지) 29일치에 표지논문으로 발표됐다.
인체에 존재하는 4만여개의 단백질은 20개 아미노산의 결합으로 만들어진다. 사람 등 영장류만이 손을 가지고 있듯이, 단백질들 사이에도 같은 모양과 기능을 가진 특정 영역들이 존재한다. 손의 생김새를 보고 쓰임새를 짐작할 수 있는 것처럼, 이 영역의 아미노산 결합 구조를 알면 단백질의 기능을 이해하기 쉬워진다.
연구팀은 ‘TRIM’ 단백질이 에이즈 바이러스와 결합할 때 ‘B30.2/SPRY’라는 영역이 연결 부위로 작용한다는 데 착안해, 포항방사광가속기의 엑스레이로 이 영역의 3차원 구조를 밝혀냈다. 또 이 영역의 특정 부분이 다른 단백질 안에 있는 비교적 짧은 6개의 아미노산으로 이뤄진 부분과 결합한다는 사실을 알아냈다.
논문 제1저자인 우재성(28·포스텍 박사과정)씨는 “‘B30.2/SPRY’ 영역을 가지고 있는 단백질은 사람 몸에 모두 150여종으로, 에이즈 같은 바이러스 질병이나 오피츠증후군, 가족성지중해열 등 유전질환 관련 단백질들이 포함돼 있다”며 “이번 연구는 질병 원인 유전자의 작용 메커니즘을 밝히는 데 기초가 돼 궁극적으로 신약 개발에 도움이 될 것”이라고 말했다. 이근영 기자
kylee@hani.co.kr
광고


기사공유하기